선택적 오토파지에 의한 RNA 스플라이싱 조절, 노화 연관 염증 인자의 단백질 발현 촉진
[연구필요성]
세포 내외의 여러 스트레스에 의해 유도되는 노화 세포는 다양한 노화 연관 질환 및 개체 노화의 핵심 요인으로 잘 알려져 있다. 인체 내 적은 비율로 존재하는 노화 세포가 광범위한 세포 및 조직에 악영향을 끼칠 수 있는 이유는 노화 세포로부터 대량 생산되어 분비되는 여러 염증 인자의 역할 때문이다. 노화 세포가 어떻게 세포 내 한정적인 단백질 생산 능력을 염증 인자의 발현에 집중해서 사용할 수 있는지에 대해서는 알려진 바가 극히 적었다. 노화 세포의 염증 인자 발현 조절 기전의 규명은 복잡한 스트레스 반응에 대한 이해를 증진할 뿐만 아니라, 신개념 노화 치료제 개발에 실마리를 제공함으로써 초고령화 사화에 대한 대책 마련에 기여할 수 있기에 중요하다.
[연구성과/기대효과]
선택적 오토파지는 리소좀 기반의 분해 시스템으로 세포 내 특정 단백질의 분해를 통해 여러 생물학적 프로세스를 조절할 수 있음이 알려져 있다. 본 연구진은 여러 노화 세포에서 오토파지가 스플라이싱 조절 인자 (splicing factor)의 선택적 분해를 통해 여러 RNA의 스플라이싱 패턴을 변화시킬 수 있음을 새롭게 확인하였다. 이러한 변화에는 단백질 번역 개시 인자(translation initiation factor)로 잘 알려진 EIF4H의 RNA 스플라이싱이 포함되어 있는데, 흥미롭게도 이는 세포 노화 특이적인 EIF4H 단백질의 isoform (EIF4H-S)의 생산을 촉진한다. EIF4H-S 단백질은 복잡한 구조를 가진 것으로 알려진 다양한 염증 인자의 mRNA에 특이하게 작용하여, 해당 인자의 단백질 번역을 촉진하고 노화 연관 염증 반응을 유도한다. 본 연구진은 새롭게 규명한 오토파지-스플라이싱-EIF4H-염증 인자 단백질 발현 조절 축이 신체의 다양한 조직의 노화에서 보존되어 있음을 대규모 데이터베이스 분석을 통해 확인하였다. 더불어 해당 조절 축이 노화와 밀접하게 연관된 질환인 암에서도 작용하며, 여러 암의 면역 반응을 예측하는 데 활용할 수 있음을 검증하였다.
본 연구는 오토파지가 세포 내 단백체의 기능적 리모델링을 RNA의 스플라이싱 조절을 통해 유도할 수 있다는 것을 최초로 규명하였다는 점에서 큰 과학적 의의가 있을 뿐만 아니라, EIF4H의 스플라이싱 조절을 통해 다양한 노화 연관 질환에서 핵심으로 작용하는 노화 연관 염증 반응을 억제할 수 있다는 점에서 신개념 노화 치료제 개발에 기여할 것으로 예상된다.
[본문]
세포 내외의 다양한 스트레스에 의해 유도되는 노화 세포는 나이가 들어감에 따라 신체 내에 축적되어 여러 노화 연관 질환 및 개체 노화를 일으킨다. 비교적 소수로 존재하는 노화 세포가 광범위한 세포 및 조직에 이러한 악영향을 끼칠 수 있는 것은 노화 세포로부터 대량으로 생산되어 분비되는 다양한 염증 인자(노화 연관 분비 표현형, Senescence-Associated Secretory Phenotype)의 역할 때문임이 잘 알려졌으나, 노화 세포가 어떻게 한정적인 단백질 생산 능력을 염증 인자의 발현에 집중할 수 있는지에 대해서는 미스터리로 남아 있었다. 최근 국내 연구진이 노화 세포 특이적 단백질 발현 조절 기전을 새롭게 밝혀내, 이러한 수수께끼 해결에 중요한 실마리를 제공하였다. 서울대학교 생명과학부 강찬희 교수 연구진은 11월 7일 노화 세포의 염증 인자 발현을 선택적으로 증가시키는 다채로운 생체 분자 오케스트레이션을 규명했다고 밝혔다.
노화 세포는 분열하지 않는 세포임에도 불구하고 높은 에너지-대사 활성을 보이는데, 이는 노화 세포의 특징적인 염증 인자의 대량 생산 및 분비에 활용된다. 이 때문에 노화 세포는 단백질 독성 스트레스(Proteotoxic stress)를 겪게 되며, 이를 완화하기 위해 단백질 번역 인자의 일반적 사용을 제한한다. 따라서 이런 제한적인 상황에서 노화 세포가 어떻게 염증 인자의 단백질 생산을 선별적으로 증가시킬 수 있는지는 큰 의문으로 남아 있었다. 연구진은 이 수수께끼를 풀기 위해 노화 세포가 리소좀 분해 시스템인 오토파지를 활용하여 다양한 스트레스 반응을 조절할 수 있다는 점에 주목하였다. 연구진은 오토파지가 스플라이싱 인자의 선택적 분해를 통해 세포 노화 과정 동안 특정 RNA의 스플라이싱 변화를 일으킴을 새롭게 규명하고, 해당 변화를 억제할 때 노화 세포로부터 분비되는 해로운 염증 인자의 단백질 생산이 크게 저해할 수 있음을 확인하였다.
연구진은 서울대학교 생명과학부 김종서 교수 연구진과 협업을 통해 개발한 ‘노화 연관 단백질 번역체 분석 기술’을 활용하여 염증 인자의 단백질 번역을 선택적으로 촉진하는 핵심 인자인 EIF4H-S의 기능 또한 규명하였다. EIF4H-S는 여러 염증 인자 mRNA의 복잡한 5’ 비번역 부위(5’ UTR)의 구조를 풀 수 있는 EIF4A의 활성 조절을 통해 해당 인자의 선택적 단백질 생산을 촉진하고 노화 연관 염증 반응을 유도한다. 연구진은 마지막으로 새롭게 규명한 오토파지-스플라이싱-EIF4H-염증 인자 단백질 발현 조절 축이 신체의 다양한 조직 노화와 노화와 밀접하게 연관된 질환인 암에서도 보존되어 있음을 대규모 데이터 베이스 분석을 통해 검증하였다.
강찬희 교수는 “이번 연구는 오토파지가 세포 내 단백체의 기능적 리모델링을 RNA의 스플라이싱 조절을 통해 유도할 수 있다는 것을 최초로 규명하였다는 점에서 과학적 의의가 있을 뿐만 아니라, EIF4H의 스플라이싱 조절을 통해 노화 연관 염증 반응을 제어할 수 있다는 점에서 새로운 노화 치료 전략 수립에 기여할 수 있다”라며 “현재 KAIST 의과학대학원의 김진국 교수 연구팀과 EIF4H 스플라이싱 제어 기술을 개발하고 있다”라고 밝혔다.
서울대학교 생명과학부 강찬희 교수 연구진이 서울대학교 생명과학부 김종서 교수 연구진과 협업하여 수행한 이번 연구는 서경배과학재단, 한국연구재단, 그리고 미래창조과학부의 지원을 받았으며, 생명과학 분야 최고 권위지 셀(Cell)의 자매지이자 발생 생물학 분야 최고 국제학술지 ‘디벨롭멘탈 셀(Developmental Cell)’에 11월 7일 공개됐다.
[연구결과]
Autophagy-dependent splicing control directs translation toward inflammation during senescence
Jaejin Kim, Yeonghyeon Lee, Taerang Jeon, Seonmin Ju, Jong-Seo Kim, Mi-Sung Kim, and Chanhee Kang
(Developmental Cell, in press, https://doi.org/10.1016/j.devcel.2024.10.008)
세포 단백체는 세포의 기능 상태를 결정하는 기본 요소로 종종 노화를 비롯한 여러 질환 등의 병리적인 상황을 유도·유지하도록 변형된다. 리소좀 기반의 분해 시스템인 오토파지는 주로 손상되거나 불필요한 단백질의 분해를 통해 세포 단백체의 항상성을 유지하는 것이 잘 알려져 있다. 하지만 오토파지가 스트레스 상황에 따라 맞춤형으로 세포 단백체를 변형하고 세포 기능을 조절할 수 있는지에 대해서는 알려진 바가 없었다. 본 연구진은 다양한 노화 연관 질환 및 개체 노화의 주요 원인으로 작용하는 세포 노화 상황에서 오토파지가 선택적 단백질 분해와 RNA 스플라이싱 조절을 연결하여 단백질 번역 프로그램을 변형하고 염증 반응을 촉진할 수 있음을 새롭게 확인하였다. RNA 스플라이싱은 세포 노화 상황에서 유의미하게 변화하며, 흥미롭게도 이 중 단백질 번역 개시 인자인 EIF4H의 RNA 스플라이싱 변화(노화 특이적 EIF4H-S isoform 형성)를 포함한 일부 변화는 오토파지에 의해 조절된다. 본 연구진은 시스템 수준의 단백질 번역체 프로파일링을 통해 EIF4H 스플라이싱 변화가 세포 노화 상황에서 염증 인자의 단백질 번역 및 생산을 증가시키는데 핵심으로 작용함을 검증하였다. 세포 노화 특이적 RNA 스플라이싱 변화는 오토파지 수용체인 NBR1 매개 선택적 오토파지에 의해 스플라이싱 조절 인자인 SFPQ가 분해되어 촉진된다. 본 연구진은 대규모 데이터베이스를 활용하여 이러한 오토파지 중심의 EIF4H 스플라이싱 변화-염증 인자 단백질 발현 조절 축이 신체의 다양한 조직 노화와 암 발생에서도 잘 보존되어 있음을 확인하였다. 본 연구는 오토파지가 세포 단백체의 기능적 리모델링을 새로운 방식으로 조절할 수 있음을 규명하였을 뿐만 아니라, 오토파지-RNA 스플라이싱-염증성 단백질 번역이라는 생체 분자 오케스트레이션에 의해 암을 비롯한 다양한 노화 연관 질환 및 개체 노화에 주요 원인으로 작용하는 노화 연관 염증 반응이 조절됨을 보였다. 본 연구는 해당 조절 축의 제어를 통해 광범위한 노화 연관 질환에 대한 효과적인 노화 치료제 개발 전략에 실마리를 제공한다는 점에서 그 중요성이 부각된다.
- ○세포 노화(Cellular senescence): 세포 노화랑 다양한 스트레스(예) 텔로미어 손실, DNA 손상 반응, 활성 산소 스트레스, 종양 유도 스트레스)에 의해 정상 세포가 분열을 비가역적으로 멈추고 다양한 염증 유발 인자를 분비하는 현상을 말한다. 노화 세포의 축적은 주변 정상 세포 및 조직의 기능을 저하하고, 개체 노화 및 다양한 노화 연관 질환을 유발한다. 최근 노화 세포를 제어함으로써 노화를 억제할 수 있다는 것이 보고되면서, 세포 노화는 현재 노화 치료제 개발의 표적으로 크게 부각되고 있다.
- ○세포 단백체(Cellular proteome): 세포 내 단백질의 총집합
- ○RNA 스플라이싱(RNA splicing): 전구체 mRNA(pre-mRNA)가 전령 RNA(mature mRNA)로 변형되는 프로세스로 주로 비암호화 부위인 인트론(Intron)이 제거되고 암호화 부위인 엑손(Exon) 끼리 연결되는 과정을 말한다. 다양한 인트론/엑손 스플라이싱 패턴 조절에 따라 동일한 유전자에서 서로 다른 기능을 가진 단백질을 만들어 낼 수 있어(alternative splicing), 세포 단백체의 다양성에 기여한다.
- ○오토파지(Autophagy): 리소좀(Lysosome) 기반의 세포 내 분해 시스템으로 크게 비특이적인 분해를 조절하는 일반적 오토파지(General autophagy)와 특이적 분해를 조절하는 선택적 오토파지(Selective autophagy)로 나눌 수 있다. 선택적 오토파지는 주로 오토파지 수용체(Autophagy receptor)에 의해 특이성이 부여된다.
- ○단백질 번역(Protein translation): 전령 RNA의 염기서열을 단백질의 아미노산 서열로 번역하는 센트럴 도그마(Central dogma)의 과정이다. 해당 과정은 세포 내 단백질 합성 공장인 리보솜과 단백질 번역 개시 인자(Protein translation initiation factor)를 비롯한 다양한 단백질 번역 조절 인자에 의해 조절된다.
[그림설명]
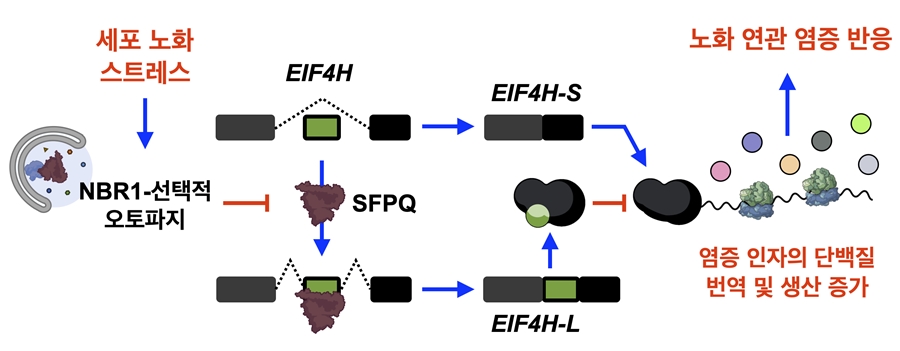
오토파지 매개 RNA 스플라이싱 조절에 의한 새로운 노화 연관 염증 반응 조절 기전: 세포 노화를 유도하는 다양한 스트레스는 오토파지 수용체 NRB1 매개 선택적 오토파지를 촉진하여, 스플라이싱 조절 인자 SFPQ의 분해를 유도한다. 해당 변화는 단백질 번역 개시 인자 중 하나인 EIF4H의 스플라이싱 변화를 일으켜 세포 노화 특이적 isoform인 EIF4H-S의 양을 증가시킨다. EIF4H-S는 일반 isoform인 EIF4H-L과 경쟁하며 여러 염증 인자의 특이적 단백질 번역 및 생산을 증가하여 노화 연관 염증 반응을 일으킨다.

