- 글리벡 내성을 억제하는 신규 약물 타겟 사이토카인 규명 -
[연구 필요성]
만성 골수성 백혈병은 BCR이라는 유전자와 ABL이라는 유전자가 염색체내에서 합쳐지면서 연결되면서 나타나는 BCR-ABL이라는 유전자에 의해 일반적으로 일어난다.
만성골수성 백혈병은 2001년 인류 최초의 BCR-ABL를 타겟으로 하는 표적항암제 글리벡이 사용되면서 환자의 생존률이 급격히 늘어났다. 하지만, 글리벡에 대한 내성이 ABL 유전자의 돌연변이가 생기면서, 환자의 생존에 심각한 영향을 주었지만, 2세대와 3세대 약물이 개발되면서 돌연변이에 의한 내성은 해결되고 있다.
하지만, 돌연변이가 나타나지 않음에도 불구하고 내성이 일어나는 환자들이 발생하는데, 전체 환자에서 나타나는 내성의 50%를 차지하고 있다.
따라서, 돌연변이가 없어도 내성이 일어나는 이유를 밝혀내고, 그 치료 타겟을 찾아내는 것은 만성골수성 백혈병 환자의 완치를 위해 필요한 연구이다.
[연구성과/기대효과]
본 연구에서는 BCR-ABL의 돌연변이 없이 내성이 생기는 원인 기전을 밝혀내었다. 그 과정에서 FAM167A라는 신규 사이토카인이 내성을 일으키는데에 있어 중요한 역할을 함을 밝혀내었다.
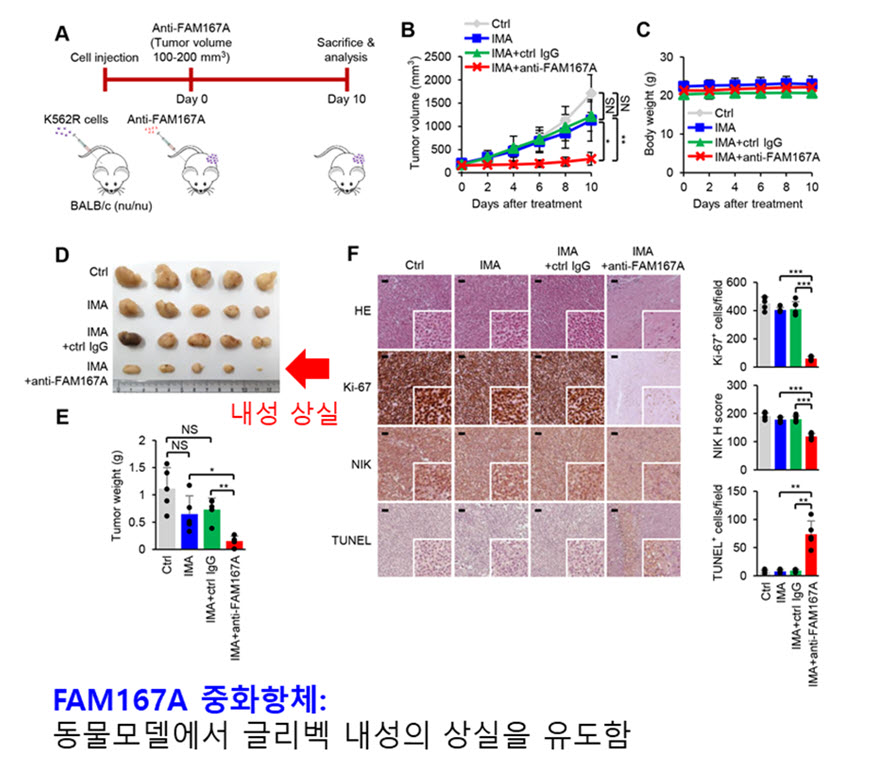
연구 결과에서는 FAM167A를 중화항체로 저해하였을 때, 내성이 사라짐을 통해, FAM167A의 중화가 돌연변이 비의존적 내성을 억제하는 치료법으로 사용될 수 있음을 동물 실험을 통하여 보여주었다.
본 연구결과를 토대로 한 후속 연구를 통해 FAM167A에 대한 사람의 중화항체의 개발은 돌연변이 비의존적 내성을 치료할 수 있는 생물학적 제재로 활용되어 만성 골수성 백혈병 환자의 완치에 한걸음 다가가게 할 것이다.
[본문]
서울대학교 약학대학 박성규 교수(제약학과) 연구팀 (제1저자 양태우)은 만성골수성 백혈병의 글리벡 내성을 일으키는 새로운 원인 기전을 밝혀내었다. 이 내성에서 연구팀은 신규 사이토카인인 FAM167A를 규명하였으며, 동물 실험을 통해 FAM167A의 억제가 내성 환자를 위한 새로운 치료법이 될 수 있음을 제시하였다.
만성 골수성 백혈병은 성인에서 발생하는 백혈병의 약 10%를 차지하며, 2001년 이후 표적항암제의 개발로 장기간 생존하는 환자가 늘어나면서 치료를 받고 있는 환자 수가 급속히 증가하고 있다.
- ○만성 골수성 백혈병은 BCR이라는 유전자와 ABL이라는 유전자가 염색체내에서 합쳐지면서 연결되면서 나타나는 BCR-ABL이라는 유전자에 의해 일반적으로 일어난다.
- ○만성골수성 백혈병은 2001년 인류 최초의 BCR-ABL를 타겟으로 하는 표적항암제 글리벡이 사용되면서 환자의 생존률이 급격히 늘어났다. 하지만, 글리벡에 대한 내성이 ABL 유전자의 돌연변이가 생기면서, 환자의 생존에 심각한 영향을 주었지만, 2세대와 3세대 약물이 개발되면서 돌연변이에 의한 내성은 해결되고 있다.
BCR-ABL의 돌연변이에 의한 내성은 새로운 표적항암제에 의해 해결되고 있지만, 돌연변이 비의존적 글리벡 내성 원인은 아직 밝혀지지 않았다.
- ○BCR-ABL을 표적으로 하는 글리벡과 2세대 표적항암제는 ABL의 특정 돌연변이에 의해 결합력이 약화되어 만성 골수성 백혈병 세포가 내성을 가지도록 한다. 하지만, 개선된 3세대 표적항암제는 돌연변이에도 작용할 수 있도록 설계되어, 돌연변이에 의한 내성이 해결되고 있다.
- ○하지만, ABL에 돌연변이가 일어나지 않아도 내성이 생기는 경우가 전체 환자의 50%를 차지하며, 이로 인하여, 치료를 받고 있는 환자의 생존에 큰 위협을 주고 있다. 하지만, 아직 그 원인 기전이 여전히 연구중이다.
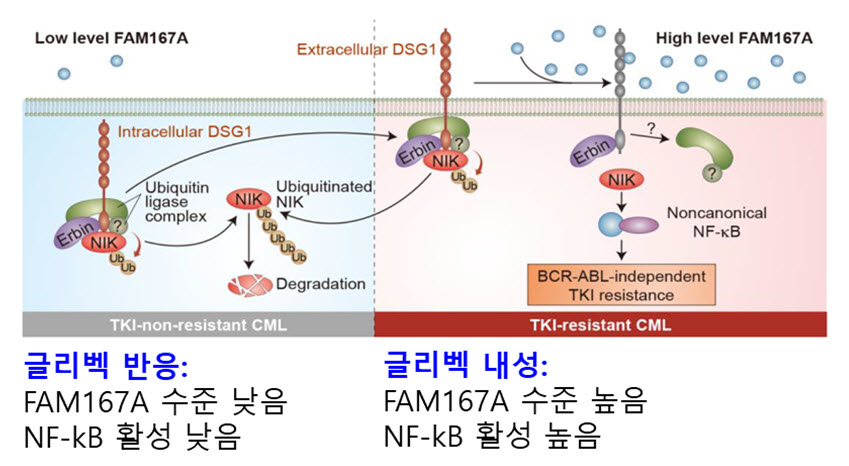
본 연구에서는 ABL 돌연변이 비의존적 내성의 원인으로 지목된 FAM167A는 백혈병 세포의 NF-kB를 활성화시켜 글리벡 및 2세대, 3세대 표적항암제에 대한 내성을 일으키는 것으로 밝혀내었다.
- ○ABL의 돌연변이가 없는 글리벡 내성 세포주에서 본 연구에서 밝혀낸 신규 사이토카인 FAM167A가 급격히 늘어나 있음을 본 연구진은 찾아내었고, 또한, ABL 돌연변이 비의존적 내성 환자에서도 FAM167A가 증가되어 있는 것을 알아냈다.
- ○내성세포 및 내성환자의 백혈병 세포에서의 FAM167A의 증가에 착안하여, FAM167A를 중화항체로 저해한 결과 내성세포의 사멸 유도와 동물 모델에서의 만성 골수성 백혈병 세포의 내성이 저해됨을 확인하였다.
본 연구팀의 결과는 돌연변이 비의존적 내성환자 치료를 위한 FAM167A 중화항체 개발로 활용될 것으로 기대된다.
이번 연구는 한국연구재단 (중견연구자 지원사업)의 지원으로 수행되었으며, 국제학술지 “Journal of Experimental and Clinical Cancer Research” (IF: 11.161)에 3월 4일 (금) 게재되었다.
- ○논문명: FAM167A is a key molecule to induce BCR-ABL-independent TKI resistance in CML via noncanonical NF-κB signaling activation
[연구결과]
FAM167A is a key molecule to induce BCR-ABL-independent TKI resistance in CML via noncanonical NF-kB signaling activation
Taewoo Yang, Kyu-Young Sim, Gwang-Hoon Ko, Jae-Sook Ahn, Hyeoung-Joon Kim, and Sung-Gyoo Park
배경: BCR-ABL 돌연변이 비의존적 약물 내성은 만성 골수성 백혈병(CML)의 치료에 장벽으로 작용합니다. 그러나, BCR-ABL-비의존적 티로신 키나제 억제제(TKI) 내성의 기초가 되는 분자 경로는 아직 밝혀지고 있지 않습니다.
결과: 우리는 유전자 발현 정보 분석을 통해 NF-κB가 BCR-ABL-돌연변이 비의존적 TKI-내성 만성 골수성 백혈병 세포에서 유전자 발현에 가장 큰 영향을 미친다는 것을 발견했습니다. FAM167A가 NF-κB 경로를 활성화하고 BCR-ABL 돌연변이 비의존적 TKI 내성을 유도한다는 것을 발견했습니다. 분자 분석 결과에서는 FAM167A가 세포 접착 단백질 DSG1에 결합하여 유비퀴틴화를 차단함으로써 NF-κB 유도 키나제(NIK)를 조절함으로써 NF-κB 경로를 활성화한다는 것을 보여주었습니다. 마우스 종양 모델에서 FAM167A의 중화는 NF-κB 활성을 감소시키고 TKI에 대한 세포의 내성을 억제하였습니다. 또한, FAM167A 및 표면 DSG1 수준은 BCR-ABL 돌연변이 비의존적 TKI 내성 질환 환자의 CD34+ CML 세포에서 그 발현 수준이 높음을 확인하였습니다.
결론: 이 결과는 FAM167A가 NF-κB 경로를 활성화하여 만성 골수성 백혈병 세포에서 BCR-ABL 돌연변이 비의존적 TKI 내성에 대한 필수 인자로 작용함을 보여줍니다. 또한, FAM167A는 BCR-ABL 비의존적 TKI 내성에 대한 중요한 표적 및 바이오마커 역할을 할 수 있습니다.
[용어설명]
※ BCR-ABL, BCR이라는 유전자와 ABL이라는 타이로신 키나아제 유전자가 염색체간 결합에 의한 BCR-ABL로 결합되어 발현되는 단백질로 만성골수성 백혈병을 일으키게 된다.
※ FAM167A, 세포외부로 분비되는 신규 사이토카인으로 본 연구에서 NF-kB의 활성화를 유도하는 사이토카인으로 밝혀내었다.
※ NF-kB, 세포의 생장과 생존에서 중요한 전사인자
[그림설명]