
이철우(Chulwoo Rhee), 앤 워텔(T. Anh Wartel), 제롬 킴(Jerome H. Kim)
국제 백신 연구소(International Vaccine Institute)
〈COVID-19 Vaccine Race〉
그림: 원광대학교 산본병원 외과 박수진 교수
서론
SARS-CoV-2 대유행은 끝이 보이지 않고 지역사회 및 국가간 전파를 통해 지속되고 있다. [1]. 수십만 명의 사망, 1,500 만 명 이상의 감염, 헤아릴 수 없는 삶의 붕괴, 그리고 전 세계적으로 사회 경제적 파장을 일으켰다[2-3]. 동반 질환이 있는 노인 그리고 사회 경제적 지위가 낮고 의료에 대한 접근성이 떨어지는 집단은 이 치명적인 바이러스에 가장 취약하다 [4-5]. 이 전염병을 종식시키기 위해서는, 새로운 감염을 예방하고 집단 면역을 형성하여 서서히 COVID-19 이전의 정상 상태로 회복하는 것을 도와 줄 SARS-CoV-2에 대한 안전하고 효과적인 백신이 시급하다. 2020 년 7 월 20 일까지 24 개의 백신 후보가 임상 시험에 들어 갔으며, 142 개의 후보가 전임상 개발 단계에 있다 (그림 1) [6]. 본 원고에서는 7월 말을 기준으로 동료심사를 거친 저널에 보고되거나 중간 결과를 공개적으로 발표 한 5 개의 백신 후보에 대한 예비 결과를 요약하고자 한다.
그림1. 백신 플랫폼에 의해 세계 보건 기구에 보고 된 백신 후보 수
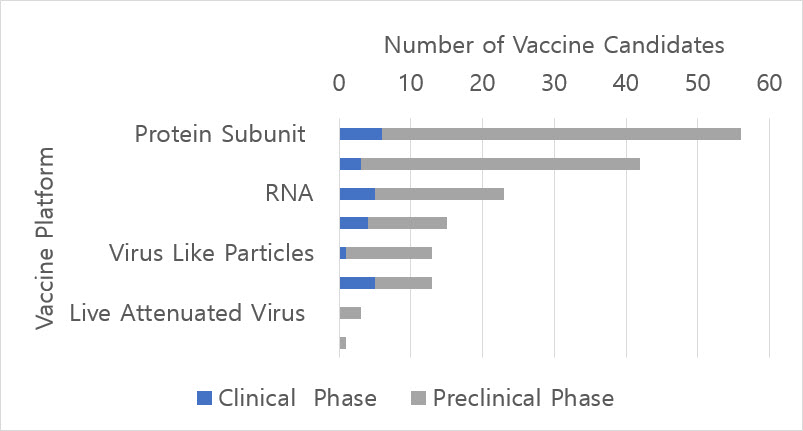
WHO Blueprint COVID-19 Landscape Report as of 20JUL2020 was used to create this figure.
1. CanSino Non-replicating Adenovirus type-5 (Ad5) Vectored Vaccine
이 1상 연구는 COVID-19의 첫 확진 사례가 보고된 진원지인 후베이성 우한에서 [8] Ad5 벡터 COVID-19 백신 후보에 대한 단일 센터, 공개 라벨, 비 무작위, 용량 증량 시험이다 [7]. 18-60 세의 건강한 성인 108 명을 대상으로 임상시험을 진행하였으며, 각각 36 명을 저용량 (5x1010 바이러스 입자), 중간 용량 (1x1011 바이러스 입자) 및 고용량 (1.5x1011 바이러스 입자) 그룹에 배정하였다. 그 결과 저용량 및 중간 용량 그룹보다 고용량 그룹에서 면역원성이 더 높게 나타났으며 고용량 그룹은 상대적으로 더 높은 면역원성을 보였다 [9]. 18 세 이상의 지원자 603 명을 대상으로 추가적인 무작위 배정, 이중 눈가림법, 위약 대조, 2상 시험이 진행 중이다. 중간 결과에 따르면 저용량 Ad5 벡터 백신의 안전성이 확인되었고, 대부분의 연구 대상자에서 단일 접종만으로 유의한 면역반응을 보인 것으로 확인되었다 [10].
2. University of Oxford/AstraZeneca Non-replicating Chimpanzee Adenovirus-Vectored (ChAdOx1 nCoV-19) Vaccine
ChAdOx1 nCoV-19 백신은 SARS-CoV-2의 스파이크 단백질을 포함하는 복제불능 원숭이 아데노 바이러스 벡터로 구성되었다. ChAdOx1 nCoV-19 백신 또는 수막구균 접합 백신을 접종하는 1/2 상, 참가자 눈가림법, 다기관, 무작위 대조 시험을 1,090명 대상으로 진행되고 있다 [11]. 1,077 명의 연구 참여자 [12]에 대해 최근 발표된 데이터는 적절한 안전성을 나타냈으며, 단일 접종 후 미세중화항체 분석법 및 50% 플라크 감소 중화항체검사법으로 측정한 SARS-CoV-2에 대한 중화 항체 반응은 각각 91% (32명/35명)과 100% (35명/35명)로 확인되었다. 10 명의 피험자는 첫 번째 접종 28일 후에 추가 접종을 받았고, 100 % (10명/10명)에서 중화 항체 반응을 보였다. 스파이크 특이적 T 세포 반응은 14일 후에 최고조에 달했다. 현재 연령층을 확대하여 2상 시험 [13]과 3상 시험 [14]을 진행 중이다.
3. Moderna mRNA Vaccine
지질 나노 입자로 캡슐화된 뉴클레오사이드 변형 메신저 RNA(mRNA) 기반 백신 인 mRNA-1273은 숙주 세포 부착과 세포로의 바이러스 유입을 매개하는 스파이크 당단백질을 코딩한다 [15]. 1상 연구는 용량을 늘리는 공개 라벨 디자인으로 45명의 건강한 18-55 세 성인을 대상으로 진행되었다. 후보 백신은 28 일 간격으로 25μg, 100μg 또는 250μg의 용량으로 두 번 접종하였다 [16]. 중간 분석 결과, mRNA-1273은 full-length S-2P 과 수용체 결합 도메인에 대한 강력한 결합 항체 반응과 용량 반응 관계를 나타냈고, 2 회 백신 접종 후 결합 및 중화 항체 역가는 회복기 혈청에서 발견되는 것과 유사했다. 600 명의 참가자를 목표로 한 2a 상, 무작위 배정, 관찰자 눈가림법, 위약 대조, 용량 확인 임상 시험 등록이 진행 중이고 [17], 효능을 평가하기 위해 18 세 이상 성인 3,000 명을 대상으로 3상 무작위 배정, 층화, 관찰자 눈가림법, 위약 대조 임상 시험이 계획 중에 있다 [18].
4. BioNTech/Pfizer 3 LNP-mRNA Vaccine
4개의 mRNA 구조, SARS-CoV-2 수용체 결합 도메인 (RBD)을 발현하는 뉴클레오시드 변형 메신저 RNA 백신 후보는 45명을 대상으로 하는 세 단계로 구성된 위약 대조 관찰자 눈가림법 임상 시험을 통해 평가되고 있다 [19]. 1단계는 최적의 백신 후보, 용량 및 접종 횟수 식별, 2단계는 예방 접종 연령대 확대, 그리고 3단계는 안전성과 효능 평가를 목표로 한다. 화이자 (Pfizer)와 바이오엔텍 (BioNTech)은 4개의 후보 중 하나 인 BNT162b1이 초기 데이터에서 RBD- 결합 IgG 항체와 SARS-CoV-2 중화 항체를 유도한다고 공동 발표했다 [20]. 진행중인 임상 시험 결과를 바탕으로 앞으로 시행될 대규모 글로벌 2b/3 상 안전성 및 유효성 연구의 주요 후보 및 용량을 결정할 수 있을 것이다.
5. Inovio DNA Vaccine with Electroporation
SARS-CoV-2에 대한 DNA 플라스미드 백신 후보 인 INO-4800에 대해서 현재 미국과 한국에서 임상 시험을 진행 중이다 [21, 22]. INO-4800의 1상 임상 시험은 18-50 세 건강한 성인 40 명을 대상으로 진행하였으며, 참가자 20 명에게 각각 1.0mg 또는 2.0mg을 4주 간격으로 두 번 접종했다. 접종은 피내 주사 후 세포 내 플라스미드 백신을 효과적으로 전달하기 위해 전기 천공법(electroporation) 을 시행했다. 6주차에 체액성 및 세포성 면역 반응이 보고되었고, 동물 연구 결과와[24] 일치하는 94 %의 전체 면역 반응률을 나타냈다 [23].
결론
공공 연구비의 적극적인 지원, 민관-공공 파트너십 전략, 글로벌 협력 및 경쟁적인 R & D 환경은 SARS-CoV-2 백신 개발을 가속화하였고, 바이러스 및 유전자 서열이 확인된 지 몇 개월도 지나지 않아 신속하게 백신 후보들에 대한 효능성 시험이 가능해졌다. 백신 후보들은 안전성 및 내약성(tolerability)뿐 아니라, 뛰어난 체액성 및 세포성 면역 반응을 나타냈다. 추후 2b/3 상 시험을 통해 안전성과 효능에 대한 근거를 축적해 나갈 예정이다. 하지만 희귀한 부작용 및 효과 지속성을 확인하기 위해 장기간(연구 완료 후 최소 1-2 년) 동안 연구 참여자들을 추적 관찰할 필요가 있다. 마지막으로, 모든 백신에 대해 신속하고 공정한 배포 및 공평한 접근성을 보장하기 위한 체계가 중요하다 [25].
Global COVID-19 Vaccine Race; Where are we at right now?
Chulwoo Rhee, T. Anh Wartel, Jerome H. Kim
International Vaccine Institute
Introduction
The SARS-CoV-2 pandemic continues, sustained by chains of transmission and crisscrossing international borders, without an end in sight [1]. It counts hundreds of thousands of deaths, over 15 million infections, immeasurable disruption of lives, and dislocation of society and economies on a global scale [2-3]. Elderly populations with pre-existing comorbidities, people with low socio-economic status and sub-optimal access to medical care are the most vulnerable to this deadly virus [4-5]. To put an end to this pandemic, a safe and effective vaccine against SARS-CoV-2 is urgently needed to prevent new infections, establish herd-immunity, and slowly return to pre-COVID-19 normality. As of 20 July 2020, 24 vaccine candidates have entered into clinical evaluation, with 142 candidates at preclinical development stage (Figure 1) [6]. In this article, we would like to summarize preliminary findings of five vaccine candidates that have reported in peer-reviewed journals or have publicly announced interim results.
Figure 1. Number of Vaccine Candidates Reported to World Health Organization by Vaccine Platform
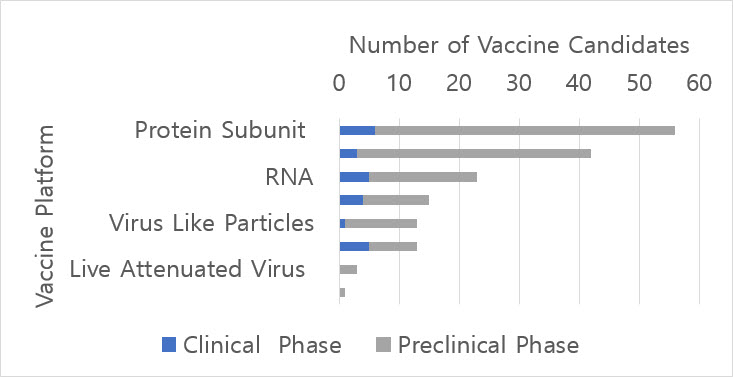
WHO Blueprint COVID-19 Landscape Report as of 20JUL2020 was used to create this figure.
1. CanSino Non-replicating Adenovirus type-5 (Ad5) Vectored Vaccine
The phase I study is a single-center, open-label, non-randomized, dose-escalation trial of an Ad5 vectored COVID-19 vaccine candidate conducted in Wuhan, Hubei Province [7], the epi-center where reported the first outbreak of COVID-19 in China [8]. The study which enrolled 108 healthy adults between 18-60 years, 36 each in low-(5x1010 viral particles), middle-(1x1011 viral particles), and high-dose (1.5x1011 viral particles) groups, showed that the high dose of the vaccine candidate tended to be more immunogenic than the low- and middle-dose vaccines, and it was also associated with a relatively higher reactogenicity profile in the high dose group [9]. Further clinical development with a randomized, double-blinded, placebo-controlled, phase II study in 603 volunteers aged 18 years or older is underway and the interim results confirmed Ad5-vectored vaccine with low dose (5x1010 viral particles) is safe and induced significant immune responses in the majority of the study participants after a single dose. [10].
2. University of Oxford/AstraZeneca Non-replicating Chimpanzee Adenovirus-Vectored (ChAdOx1 nCoV-19) Vaccine
The ChAdOx1 nCoV-19 vaccine consists of the non-replicating simian adenovirus vector, containing the spike protein of SARS-CoV-2. The phase I/II, participant-blinded, multi-center, randomized controlled trial aimed to enroll 1,090 subjects to ChAdOx1 nCoV-19 vaccine or meningococcal conjugate vaccine has completed the enrollment and is currently in follow up [11]. The recently published data from 1,077 study participants [12] showed an acceptable safety profile and demonstrated neutralizing antibody responses against SARS-CoV-2 in 91% (32/35) participants after a single dose measured in a microneutralization assay and 100% (35/35) when measured by 50% plaque reduction neutralization assay. Ten subjects were given a booster dose at 28 days after the first dose, and 100% (10/10) subjects showed neutralizing activity. Spike-specific T-cell responses peaked on day 14. Phase II with expanded age group is ongoing [13] as well as phase III study [14].
3. Moderna mRNA Vaccine
mRNA-1273, a lipid nanoparticle–encapsulated, nucleoside-modified messenger RNA (mRNA)–based vaccine, encodes the spike glycoprotein which mediates host cell attachment and viral entry to a cell [15]. The phase I study is a dose-escalation, open-label design, enrolling 45 healthy adults between 18-55 years. The candidate vaccine is given in two injections at doses of 25 μg, 100 μg, or 250 μg 28 days apart [16]. The interim analysis reported that mRNA-1273 was generally well tolerated and has shown robust binding antibody responses to both full-length S-2P and receptor-binding domain as well as dose-response relationship. Binding and neutralizing antibody titers after the two-dose vaccine series have demonstrated immune responses similar to those found in convalescent sera. Enrollment of phase IIa, randomized, observer-blind, placebo-controlled, dose-confirmation study with target size for 600 participants is on-going [17], and phase III, randomized, stratified, observer-blind, placebo-controlled study for evaluating efficacy in 3,000 adults 18 years or older is currently being planned later this summer [18].
4. BioNTech/Pfizer 3 LNP-mRNA Vaccine
Four mRNA constructs, nucleoside-modified messenger RNA vaccine candidates expressing the SARS-CoV-2 receptor binding domain (RBD), are being evaluated among 45 subjects in an ongoing placebo-controlled, observer-blinded clinical trial [19]. The study is comprised of three stages. Stage 1 aims at identifying optimal vaccine candidates, dose level, and number of doses. Stage 2 expands vaccinated age groups, and stage 3 is for safety and efficacy. Pfizer and BioNTech jointly announced that one of four candidates, BNT162b1, early data had demonstrated significant induction of RBD-binding IgG antibodies and SARS-CoV-2 neutralizing antibodies [20]. Further data from the ongoing clinical trial will enable selection of a lead candidate and dose level for a large, global phase IIb/III safety and efficacy study that may begin later this summer.
5. Inovio DNA Vaccine with Electroporation
INO-4800, a DNA plasmid vaccine candidate against SARS-CoV-2, is currently being evaluated in clinical trials in US and Republic of Korea [21, 22]. The phase I clinical trial of INO-4800 initially enrolled 40 healthy adults 18 to 50 years of age, 20 participants each with two doses of either 1.0mg or 2.0mg, four weeks apart. Each intradermal injection is followed by electroporation, a procedure intended to effectively deliver plasmid vaccine inside the cell. The biotech company announced the vaccine candidate had elicited both humoral and cellular immune response at week 6 by demonstrating a 94% overall immune response rate [23], consistent with findings from animal studies [24].
Conclusion
Aggressive provision of public research funding, public-private partnership strategies, global collaboration and a competitive R&D environment have accelerated vaccine clinical development against SARS-CoV-2, enabling a few candidates to enter efficacy trials within a few months of identification of the virus and publication of its genetic sequence. Vaccine candidates have demonstrated acceptable safety and tolerability profiles as well as promising humoral and cellular immune responses. Late stage of development with phase IIb/III trials will hopefully provide evidence of safety and efficacy in study participants. However, there is a need to also follow the study participants for longer periods (at least 1-2 years after study completion) for rare safety events detection and protection longevity. Last but not the least, it is of paramount importance that any vaccine for COVID-19 to have mechanisms in place [25] to ensure rapid roll-out, fair distribution, and equitable access to vaccine globally.
References
- 1.World Health Organization. COVID-19 as a Public Health Emergency of International Concern (PHEIC) under the IHR. Available at https://extranet.who.int/sph/covid-19-public-health-emergency-international-concern-pheic-under-ihr (Accessed on 21JUL2020).
- 2.World Health Organization. WHO Coronavirus Disease (COVID-19) Dashboard. Available at https://covid19.who.int/ (Accessed on 21JUL2020).
- 3.World Bank. Global Economic Prospects. 2020. Available at https://www.worldbank.org/en/publication/global-economic-prospects (Accessed on 21JUL2020).
- 4.EJ Williamson, AJ Walker, K Bhaskaran, et al. OpenSAFELY: factors associated with COVID-19 death in 17 million patients. Nature. 2020 Jul 8. doi: 10.1038/s41586-020-2521-4.
- 5.US Centers for Disease Control and Prevention. Evidence used to update the list of underlying medical conditions that increase a person’s risk of severe illness from COVID-19. Available at https://www.cdc.gov/coronavirus/2019-ncov/need-extra-precautions/evidence-table.html (Accessed on 21JUL2020).
- 6.World Health Organization. Draft landscape of COVID-10 candidate. Available at https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines (Accessed on 21JUL2020).
- 7.Chinese Clinical Trial Registry. A phase I clinical trial for recombinant novel coronavirus (2019-COV) vaccine (adenoviral vector). Available at http://www.chictr.org.cn/showprojen.aspx?proj=51154 (Accessed on 21JUL2020).
- 8.World Health Organization. Archived: WHO Timeline - COVID-19. Available at https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19 (Accessed on 21JUL2020).
- 9.Feng-Cai Zhu, Yu-Hua Li, Xu-Hua Guan et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet. 2020 Jun 13;395(10240):1845-1854. doi: 10.1016/S0140-6736(20)31208-3.
- 10.Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020 July. doi:https://doi.org/10.1016/S0140-6736(20)31605-6
- 11.EU Clinical Trial Register. A phase I/II study to determine efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19 in UK healthy adult volunteers. Available at https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001072-15/GB (Accessed on 21JUL2020).
- 12.PM Folegatti, KJ Ewer, PK Aley, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet. 2020 Jul. https://doi.org/10.1016/S0140-6736(20)31604-4
- 13.EU Clinical Trial Register. A phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-1. Available at https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB (Accessed on 21JUL2020).
- 14.ISRCTN Registry. A phase III study to investigate a vaccine against COVID-19. Available at http://www.isrctn.com/ISRCTN89951424 (Accessed on 21JUL2020).
- 15.Moderna. Moderna’s Work on a COVID-19 Vaccine Candidate. Available at https://www.modernatx.com/modernas-work-potential-vaccine-against-covid-19 (Accessed on 21JUL2020).
- 16.LA. Jackson, EJ. Anderson, NG. Rouphael et al. An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. N Engl J Med. 2020 Jul. doi: 10.1056/NEJMoa2022483.
- 17.U.S. National Library of Medicine Clinicaltrials.gov Registration. Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older. Available at https://clinicaltrials.gov/ct2/show/NCT04405076?term=moderna&cond=covid-19&draw=2 (Accessed on 21JUL2020).
- 18.U.S. National Library of Medicine Clinicaltrials.gov Registration. A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19. Available at https://clinicaltrials.gov/ct2/show/NCT04470427?term=vaccine&cond=covid-19&draw=5 (Accessed on 21JUL2020).
- 19.U.S. National Library of Medicine Clinicaltrials.gov Registration. Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults. Available at https://clinicaltrials.gov/ct2/show/NCT04368728?term=vaccine&cond=covid-19&draw=3 (Accessed on 21JUL2020).
- 20.Pfizer. PFIZER AND BIONTECH ANNOUNCE EARLY POSITIVE DATA FROM AN ONGOING PHASE 1/2 STUDY OF MRNA-BASED VACCINE CANDIDATE AGAINST SARS-COV-2. Available at https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-early-positive-data-ongoing-0 (Accessed on 21JUL2020).
- 21.U.S. National Library of Medicine Clinicaltrials.gov Registration. Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers. Available at https://clinicaltrials.gov/ct2/show/NCT04336410 (Accessed on 21JUL2020).
- 22.U.S. National Library of Medicine Clinicaltrials.gov Registration. Safety, Tolerability and Immunogenicity of INO-4800 Followed by Electroporation in Healthy Volunteers for COVID19. Available at https://clinicaltrials.gov/ct2/show/NCT04447781 (Accessed on 21JUL2020).
- 23.Inovio. INOVIO Announces Positive Interim Phase 1 Data For INO-4800 Vaccine for COVID-19. Available at http://ir.inovio.com/news-releases/news-releases-details/2020/INOVIO-Announces-Positive-Interim-Phase-1-Data-For-INO-4800-Vaccine-for-COVID-19/default.aspx (Accessed on 21JUL2020).
- 24.TRF. Smith, A. Patel, S. Ramos et al. Immunogenicity of a DNA vaccine candidate for COVID-19. Nat Commun. 2020 May;11(1):2601. doi: 10.1038/s41467-020-16505-0.
- 25. World Health Organization. More than 150 countries engaged in COVID-19 vaccine global access facility. Available at https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility (Accessed on 21JUL2020).
코로나-19 통계/역학
자료 분석: 서울의대 코로나19 과학위원회
그림 1. 일일확진자수 사망자수 및 중증도별 환자수(2020.8.27 기준)
*일일 확진자수와 국내 확진자수 차트 면적의 차이는 해외 유입 사례 수를 의미함
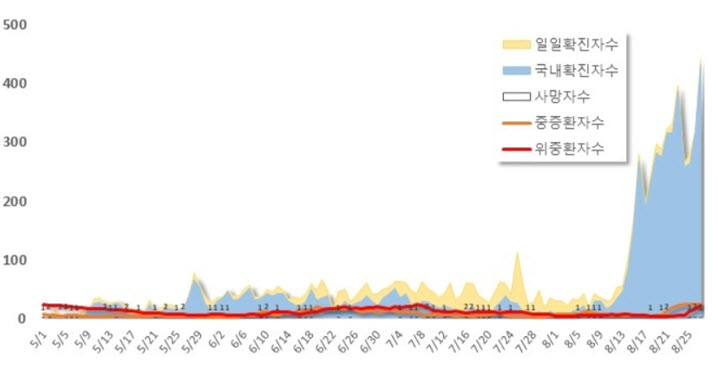
자료 출처) 질병관리본부 보도자료
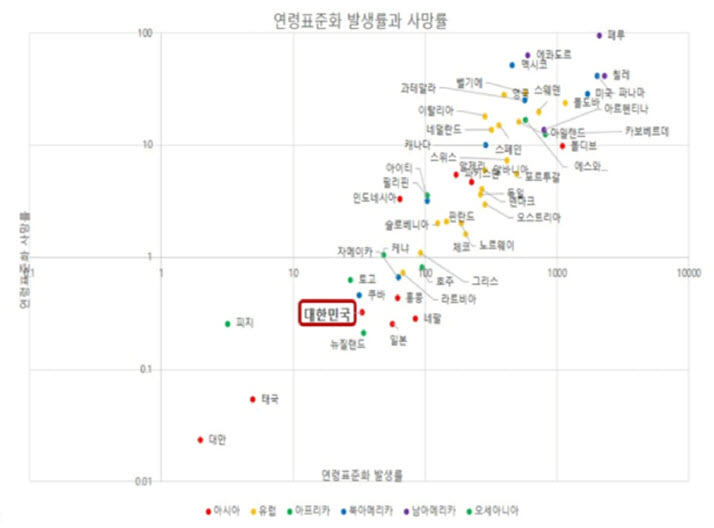
그림 2. 연령표준화 발생률과 사망률 (2020.8.28 기준)
*WHO 표준 인구 (2000-2025)로 연령 표준화 하였음
연구 동향
타액에서 SARS-CoV-2 검사하는 방안
Anne L. Wyllie et al. Saliva or Nasopharyngeal Swab Specimens for Detection of SARS-CoV. New Eng J Med., 2020. Aug 30. 비인두 면봉 검체로 확진된 70명의 코로나19 입원 환자를 대상으로 입원 중 환자가 자가 채취한 타액 검체와 같은 시점에 의료진이 채취한 비인두 검체를 수집하였음. 타액 검체와 비인두 검체에서 SARS-CoV-2 PCR 분석을 시행함. 그 결과 비인두 검체(4.93 log copies/mL, 95% 신뢰구간 4.53-5.33)에 비해 타액(5.58 log copies per mL, 95% 신뢰구간 5.09-6.07)에서 더 많은 SARS-CoV-2 를 검출하였음. 또한 코로나19 진단 후 10일 후 비인두 검체에서보다 타액에서 양성 비율이 더 높았음. 확진 1-5일 후 타액에서는 81%가 양성이었으며 비인두검체에서는 71%가 양성이었음. 환자들이 스스로 타액을 수집하여 제출할 경우 검사하는 의료진과 직접접촉을 줄이고 검체용기 및 의료보호장구 등 의료자원을 절약할 수 있으며 검체 수집을 더 신속하게 할 수 있음.
서울의대 코로나19 과학위원회 웨비나 일정
